
Regarde cette vidéo et gagne facilement jusqu'à
 15 Lumniz
en te connectant !
15 Lumniz
en te connectant !
Il n’y a pas de Lumniz à gagner car tu as déjà vu ce contenu. Ne t’inquiète pas, il y a plein d’autres vidéos, jeux, quiz ou articles intéressants à explorer et toujours plus de Lumniz à remporter.
Représentation spatiale des molécules
Physique Chimie Terminale
ORGANISATION ET TRANSFORMATION DE LA MATIERE
I. Différents types de formules
Pour représenter les molécules, il existe différents types de formules :
- La formule brute est la plus simple. Les représentations CO2 ou H2O désignent seulement le nombre d’atomes présents dans la molécule.
- La formule développée fait apparaître toutes les liaisons dans la molécule. L’acide propanoïque représenté ici en formule développée montre toutes les liaisons entre les atomes qui constituent la molécule.
- Par ailleurs, elle est peu utilisée face à la formule semi-développée.
Rappel : le carbone doit avoir quatre liaisons, l’hydrogène une liaison, l’oxygène deux liaisons, l’azote trois liaisons, etc.
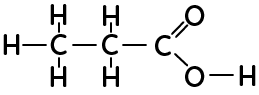
- La formule semi-développée simplifie l’écriture de la formule développée en ne représentant plus les liaisons des hydrogènes, peu réactifs.
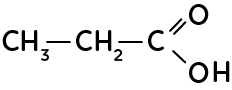
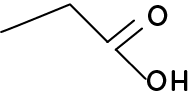
- La formule topologique est le fait de représenter la chaîne carbonée par une succession de lignes brisées où chaque point de la ligne représente un atome de carbone. Elle est majoritairement utilisée pour des protéines soit en SVT.
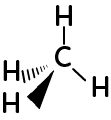
- La formule de Cram, fait apparaître la perspective dans la représentation moléculaire.
Ici, pour ce carbone tétraédrique, l’atome d’hydrogène lié au carbone par un trait plein est à l’avant ; l’atome d’hydrogène lié au carbone par les pointillés est en arrière-plan. Pour le dernier hydrogène lié au carbone par un trait simple, est exactement au même plan que le carbone.
II. Nomenclature
Comment désigner les molécules en chimie ? Il faut connaître les différentes familles et les suffixes qui y sont liées. Une partie de ces familles (mais pas la totalité) sont représentées dans ce tableau.
Familles | Suffixes |
Alcanes | -ane |
Alcool | -ol |
Alcène | -ène |
Cétone | -one |
Aldéhyde | al |
Les noms des différentes chaînes carbonées doivent être connus, comme représentés dans ce tableau :
Chaînes carbonées | Noms |
1 carbone | Méth- |
2 carbones | Eth- |
3 carbones | Prop- |
4 carbones | But- |
La règle pour la nomenclature est la suivante : on note d’abord le préfixe, puis la chaîne principale carbonée, suivie des insaturations (liées à la famille des alcènes) et enfin les fonctions. Tout cela peut être associé à des numéros qui préfigurent la position de l’insaturation, de la fonction ou du préfixe (la ramification) dans la chaîne carbonée.
III. Exemples
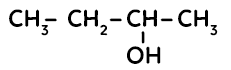
On a ici quatre atomes de carbones, qui représentent le but-. Il n’y a pas d’insaturation (double liaison), nous sommes donc dans la famille des alcanes. On a une fonction alcool également. Le résultat est un butanol. Par ailleurs, pour signifier la position de l’alcool sur le carbone n°2 (on doit ici prendre le numéro de carbone le plus petit donc prendre la chaîne carbonée dans l’autre sens), on rajoute un 2 : cela nous donne donc un butan-2-ol.
Remarque : s’il y a deux fonctions alcool, on doit mettre deux chiffres entre les tirets, ainsi que signifier que c’est une double fonction alcool avec « diol », soit par exemple : butan-2, 3-diol. De plus, en cas de ramification, cela sera spécifié à l’avant du nom, en préfixe.
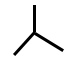
On remarque que la chaine carbonée la plus longue est de trois carbones, soit prop-. Il n’y a pas d’insaturation, mais une ramification d’un atome de carbone en position 2. Cet atome de carbone est un méthyle, cela revient donc à : méthylpropane.
Réalisateur : Les Bons Profs
Producteur : Les Bons Profs
Année de copyright : 2016
Année de production : 2016
Publié le 18/06/19
Modifié le 15/01/24
Ce contenu est proposé par




